ALS: Zelluläres Reparatursystem könnte Protein-Aggregation verhindern
Jedes Jahr werden 2500 neue Fälle von amyotropher Lateralsklerose diagnostiziert. Damit ist sie eine relativ seltene, aber sehr schwere Erkrankung des Nervensystems. Eine Heilung ist bisher nicht möglich. ALS zerstört langsam die motorischen Neuronen im Gehirn und Rückenmark, die für die willkürliche Muskelsteuerung verantwortlich sind. Die Folge ist eine fortschreitende Muskellähmung, so dass viele Patienten auf einen Rollstuhl angewiesen sind. Mit dem Fortschreiten der Krankheit fällt es den Betroffenen zunehmend schwer zu sprechen, zu schlucken und zu atmen.
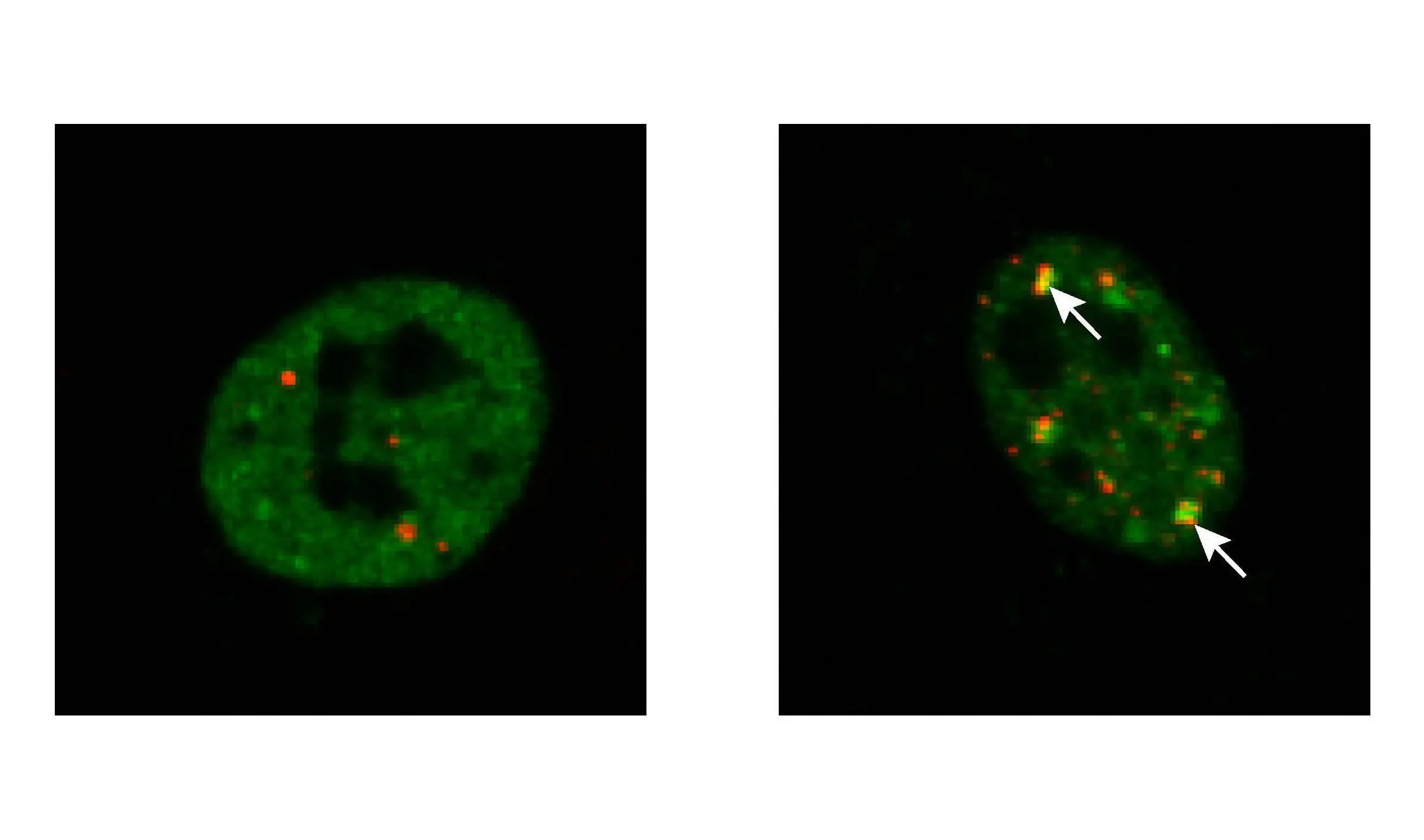
Bei ALS sammeln sich schwer lösliche Proteinaggregate in den Motoneuronen an. Neben anderen Proteinen bestehen diese Aggregate aus TDP-43, das verschiedene kritische Rollen im zellulären RNA-Stoffwechsel spielt. Während TDP-43 in gesunden Zellen hauptsächlich in löslicher Form im Zellkern vorkommt, bildet es bei ALS-Patienten schwer lösliche Aggregate, die sich hauptsächlich außerhalb des Zellkerns ansammeln. Dadurch verliert TDP-43 seine Funktionalität und führt letztlich zum Absterben der Motoneuronen.
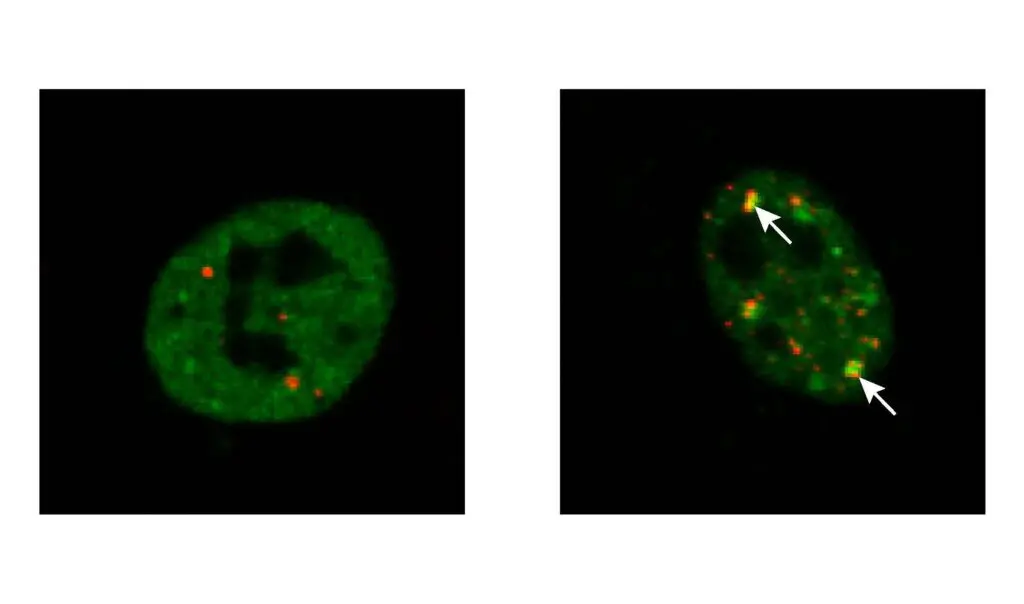
Im Rahmen des vom Bundesministerium für Bildung und Forschung (BMBF) geförderten Cluster4Future PROXIDRUGS haben Forscher der Universitäten Frankfurt, Mainz und Kiel nun einen Weg gefunden, die Bildung der schädlichen TDP-43-Aggregate in kultivierten Zellen zu verhindern. Dazu setzten die Wissenschaftler um Kristina Wagner, Dr. Jan Keiten-Schmitz und Professor Stefan Müller vom Institut für Biochemie II der Goethe-Universität die Zellen Stress aus, zum Beispiel durch eine Temperaturerhöhung oder eine chemische Substanz. Dadurch wurde ein Teil von TDP-43 aus dem Zellkern in das Zytosol freigesetzt, wo es sich in so genannten Stressgranula anreicherte.
„Die Bildung solcher Stressgranula ist ein normaler Vorgang und dient der Zelle als vorübergehender Schutzraum für Proteine, damit sie der Zelle nach Abklingen des Stresses sofort wieder zur Verfügung stehen“, erklärt Keiten-Schmitz. „Ist TDP-43 jedoch mutiert, wie es in den Zellen vieler ALS-Patienten der Fall ist, bleiben die Stressgranula bestehen, verfestigen sich zunehmend und schädigen schließlich die Nervenzellen.“
Die Wissenschaftler verhinderten erfolgreich, dass TDP-43 den Zellkern unter Stress verlässt, indem sie es mit dem „Pannenhelfer“ der Zelle – einem Protein namens SUMO – verknüpften, das TDP-43 zu einer zellulären „Mechanik“, den sogenannten Kernkörpern, lenkte. „Dadurch bleibt TDP-43 löslich, und die Kernkörperchen sorgen – wie ein Mechaniker – dafür, dass schädliche Formen von TDP-43 durch das zelluläre Recyclingsystem wiederhergestellt oder abgebaut werden“, sagt Kristina Wagner, eine Erstautorin der Studie. Unlösliche Proteinaggregate, die Zellen schädigen oder gar töten, würden so gar nicht erst entstehen.
Das Forscherteam sucht nun nach zukünftigen Wirkstoffkandidaten in Form von chemischen Verbindungen, die SUMO und TDP-43 zusammenbringen. PROXIDRUGS-Forschungsleiter Müller erklärt: „Unsere Zellkulturexperimente liefern einen ersten Grundsatzbeweis: Dieser Weg kann Zellen helfen, krankheitsfördernde TDP-43-Aggregate zu begrenzen. Auch wenn der Weg zur Entwicklung eines möglichen Medikaments zur Behandlung von ALS noch sehr lang ist, lohnt es sich auf jeden Fall, diesen Ansatz weiter zu verfolgen. Schließlich finden sich TDP-43-Aggregate auch bei anderen neurodegenerativen Erkrankungen wie der Frontotemporalen Demenz (FTD) und bei etwa der Hälfte aller Alzheimer-Patienten.“
Die Beiträge im News-Bereich werden erstellt vom X-Press Journalistenbüro
Gender-Hinweis. Die in diesem Text verwendeten Personenbezeichnungen beziehen sich immer gleichermaßen auf weibliche, männliche und diverse Personen. Auf eine Doppel/Dreifachnennung und gegenderte Bezeichnungen wird zugunsten einer besseren Lesbarkeit verzichtet.




