Neue Erkenntnisse zum Zelleintritt von Influenzaviren
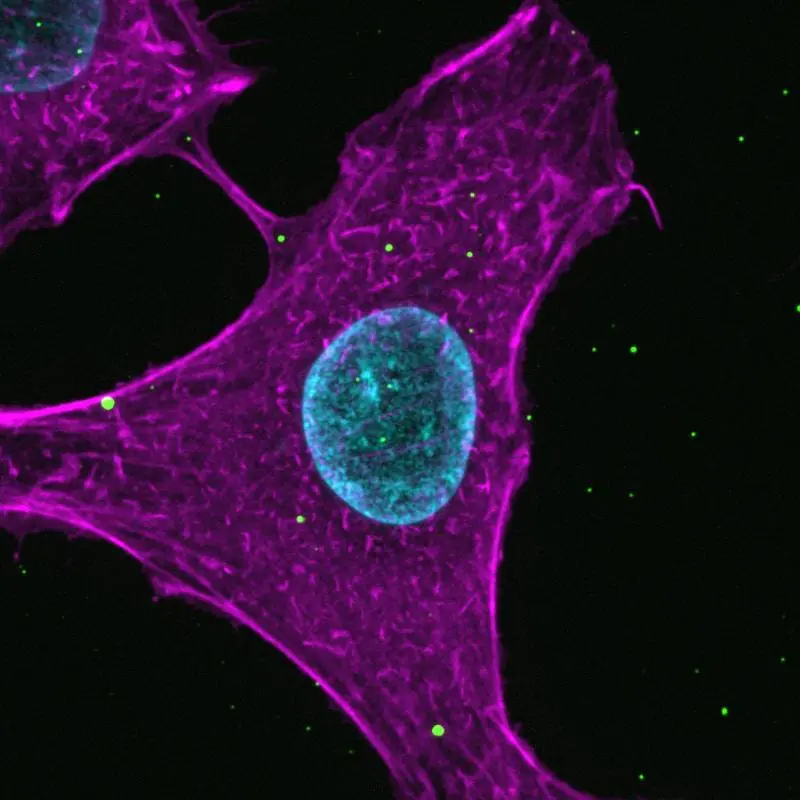
Forschende des Helmholtz-Zentrums für Infektionsforschung (HZI) in Braunschweig und des Universitätsklinikums Freiburg haben bahnbrechende Einblicke in die Mechanismen des Zelleintritts von Influenzaviren gewonnen. Mit einer neu entwickelten Methode konnten sie die Interaktion von Viren mit Wirtszellen in bislang unerreichter Detailtiefe analysieren. Ihre Ergebnisse, veröffentlicht in zwei Artikeln im Fachjournal Nature Communications, beleuchten alternative Rezeptoren, die neuartige Influenzaviren nutzen, und eröffnen Perspektiven für antivirale Therapien.

Influenzaviren gelten als potenzielle Auslöser künftiger Pandemien, da sie sich in Wirtszellen vermehren müssen, um zu überleben. Der erste Kontakt zwischen Virus und Zelloberfläche ist entscheidend, da er Infektionen ermöglicht, aber auch ein Angriffspunkt zur Verhinderung des Zelleintritts sein kann. Bisher war die Untersuchung dieses flüchtigen Moments technisch anspruchsvoll, da hochauflösende Mikroskopie im Nanomaßstab erforderlich ist. Das Forschungsteam entwickelte ein innovatives Protokoll, das Viren auf einer Glasoberfläche immobilisiert und anschließend Zellen mit diesen in Kontakt bringt. Im Gegensatz zu herkömmlichen Ansätzen, bei denen Viren auf Zellen gegeben werden, stabilisiert dieser „kopfstehende“ Aufbau den kritischen Moment des Zellkontakts, ohne dass die Viren eindringen.
Die Methode wurde zunächst an einem saisonalen Influenza-A-Virus getestet. Mit hoch- und superauflösender Mikroskopie zeigten die Forschenden, dass der Virus-Zell-Kontakt eine Kaskade zellulärer Reaktionen auslöst. Zunächst reichern sich Zellrezeptoren an der Bindestelle an, da sie sich dort langsamer durch die Zellmembran bewegen. Anschließend werden spezifische Proteine rekrutiert, und das Aktin-Zytoskelett reorganisiert sich dynamisch. Diese Erkenntnisse verdeutlichen die komplexe Dynamik der Virus-Zell-Interaktion.
Besonders aufschlussreich war die Anwendung der Methode auf das H18N11-Virus, einen neuartigen Influenzastamm, der in Fledermäusen in Mittel- und Südamerika vorkommt. Im Gegensatz zu herkömmlichen Influenzaviren, die an Kohlenhydratketten (Glykane) auf der Zelloberfläche binden, nutzt H18N11 MHC-Klasse-II-Komplexe, Proteinrezeptoren, die typischerweise auf Immunzellen vorkommen. Durch Einzelmolekülverfolgung stellten die Forschenden fest, dass MHCII-Moleküle beim Kontakt mit dem Virus an der Zelloberfläche clustern – ein entscheidender Schritt für den Zelleintritt. Dieses neue Infektionsmodell erweitert das Verständnis von Influenzaviren, insbesondere solcher mit zoonotischem Potenzial.
Die Erkenntnisse haben weitreichende Implikationen. Die Bindung an alternative Rezeptoren wie MHCII zeigt, dass Influenzaviren nicht ausschließlich auf Glykane angewiesen sind, was neue Ansätze für die Virusforschung eröffnet. Zudem bietet die entwickelte Methode eine universelle Grundlage, um Eintrittsmechanismen anderer Viren zu untersuchen. Sie ist bereits Teil des EU-Projekts COMBINE, das seit Januar 2025 den Zelleintritt pandemiegefährdender Viren erforscht. Das Projekt, koordiniert vom HZI, zielt darauf ab, diese Prozesse als Angriffspunkte für antivirale Therapien zu nutzen.
Die Ergebnisse markieren einen Meilenstein in der Infektionsforschung. Sie liefern nicht nur detaillierte Einblicke in die Biologie von Influenzaviren, sondern schaffen auch eine methodische Basis, um die Eintrittsmechanismen potenziell gefährlicher Erreger gezielt zu analysieren. Dies könnte die Entwicklung neuer Therapien beschleunigen, die Infektionen bereits am ersten Kontakt zwischen Virus und Zelle verhindern. Angesichts des pandemischen Potenzials von Influenzaviren ist dieser Fortschritt ein entscheidender Schritt, um zukünftige Gesundheitskrisen besser zu bewältigen.
Originalpublikation:
Broich, L., Wullenkord, H., Osman, M.K. et al. Single influenza A viruses induce nanoscale cellular reprogramming at the virus-cell interface. Nat Commun 16, 3846 (2025). DOI: 10.1038/s41467-025-58935-8 https://doi.org/10.1038/s41467-025-58935-8
Osman, M.K., Robert, J., Broich, L. et al. The bat influenza A virus subtype H18N11 induces nanoscale MHCII clustering upon host cell attachment. Nat Commun 16, 3847 (2025). DOI: 10.1038/s41467-025-58834-y https://doi.org/10.1038/s41467-025-58834-y
Redaktion: X-Press Journalistenbüro GbR
Gender-Hinweis. Die in diesem Text verwendeten Personenbezeichnungen beziehen sich immer gleichermaßen auf weibliche, männliche und diverse Personen. Auf eine Doppel/Dreifachnennung und gegenderte Bezeichnungen wird zugunsten einer besseren Lesbarkeit verzichtet.




