Zellbasiertes Screening: Neue Methode erlaubt Identifizierung molekularer Kleber
Forschende des CeMM Forschungszentrums für Molekulare Medizin der Österreichischen Akademie der Wissenschaften, des AITHYRA Research Institute for Biomedical Artificial Intelligence und des Scripps Research Institute haben eine systematische Methode entwickelt, um molekulare Kleber in großem Maßstab zu identifizieren. Diese Wirkstoffe lenken das zelleigene Protein-Abbausystem gezielt auf schwer angreifbare krankheitsverursachende Proteine um und führen zu deren vollständiger Entfernung aus der Zelle.
Viele Erkrankungen entstehen durch Proteine, die sich mit konventionellen Medikamenten kaum oder gar nicht hemmen lassen. Molekulare Kleber bieten hier einen alternativen Ansatz: Sie induzieren neue Wechselwirkungen zwischen einem Zielprotein und einem Abbauenzym, wodurch das Protein ubiquitiniert und im Proteasom abgebaut wird. Bislang erfolgte die Entdeckung solcher Kleber meist zufällig.
Die neue Strategie kombiniert Hochdurchsatz-Chemie mit zellbasiertem Screening. Ausgehend von einem kleinen Molekül, das bereits an ein Zielprotein bindet, erzeugten die Wissenschaftler Tausende chemische Varianten durch systematische Anhängung unterschiedlicher Bausteine. Diese Varianten verändern die Proteinoberfläche leicht und ermöglichen potenziell neue Interaktionen. Die Verbindungen wurden ohne vorherige Reinigung direkt in lebenden Zellen getestet, wobei ein sensitiver Assay den Abbau des Zielproteins nachwies.

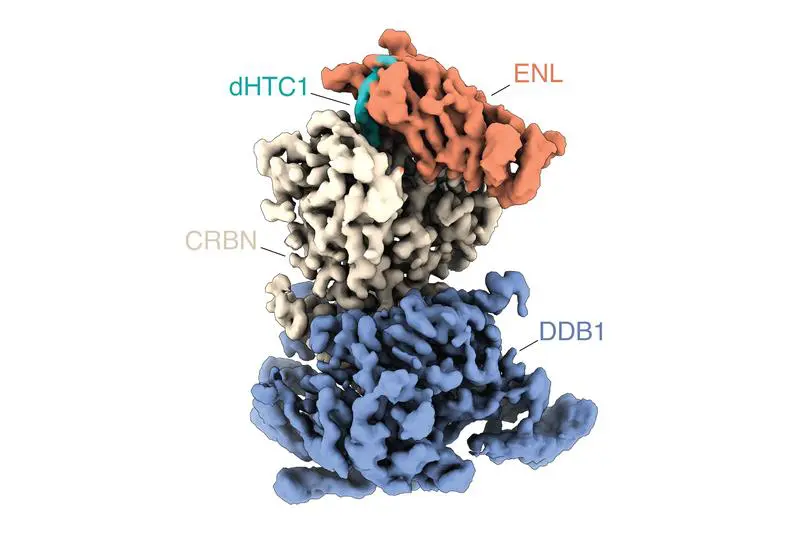
Als Proof-of-Concept konzentrierten sich die Forschenden auf das Protein ENL, das bei bestimmten aggressiven Formen der akuten Leukämie eine zentrale Rolle spielt. Aus mehreren Tausend getesteten Verbindungen identifizierten sie ein Molekül, das ENL in Leukämiezellen effizient und selektiv abbaut. Weitere Untersuchungen zeigten, dass die Verbindung vor allem ENL und die von ihm regulierten Genprogramme beeinflusst, was das Wachstum ENL-abhängiger Leukämiezellen stark hemmt. Der Wirkmechanismus ist kooperativ: Das Molekül bindet zunächst an ENL und schafft dann eine neue Interaktionsoberfläche, die eine Ubiquitin-Ligase rekrutiert und ENL für den Abbau markiert. Dieser Mechanismus sorgt für hohe Wirksamkeit und Selektivität.
Die Methode, die auf Sulfur(VI)-Fluorid-Austausch-basierter Hochdurchsatz-Chemie beruht, ist breit anwendbar und wandelt die Entdeckung molekularer Kleber von einem zufallsbasierten in einen rationalen und skalierbaren Prozess um. Langfristig könnten dadurch neue Therapieoptionen für bislang als unangreifbar geltende Proteine entstehen.
Die Studie entstand unter Leitung von Georg Winter (AITHYRA und CeMM) und Michael Erb (Scripps Research Institute). Sie ist in der Fachzeitschrift Nature Chemical Biology erschienen (DOI: 10.1038/s41589-025-02137-2).
Original Paper:
Redaktion: X-Press Journalistenbüro GbR
Gender-Hinweis. Die in diesem Text verwendeten Personenbezeichnungen beziehen sich immer gleichermaßen auf weibliche, männliche und diverse Personen. Auf eine Doppel/Dreifachnennung und gegenderte Bezeichnungen wird zugunsten einer besseren Lesbarkeit verzichtet.




