Schutzmechanismus ermöglicht Krebszellen das Überleben unter mechanischem Druck
Forschende des Exzellenzclusters CIBSS – Centre for Integrative Biological Signalling Studies der Universität Freiburg haben einen Schutzmechanismus entdeckt, der Krebszellen bei der Metastasierung vor Schäden bewahrt. Beim Durchwandern enger Gewebestrukturen sind Krebszellen hohem mechanischem Druck ausgesetzt, der die Kernhülle zum Reißen bringen kann. Normalerweise würde dies zu einem Austritt von DNA und zu Zellschäden führen. Die Studie zeigt jedoch, dass ein feines Gerüst aus Aktinfilamenten innerhalb weniger Sekunden den Zellkern stabilisiert und DNA-Verlust verhindert. Dieser Mechanismus erklärt, warum Krebszellen trotz starker Belastung ihre Wanderung fortsetzen können. Die Ergebnisse wurden im EMBO Journal veröffentlicht.
Hochleistungsmikroskopie enthüllt Schutzmechanismus
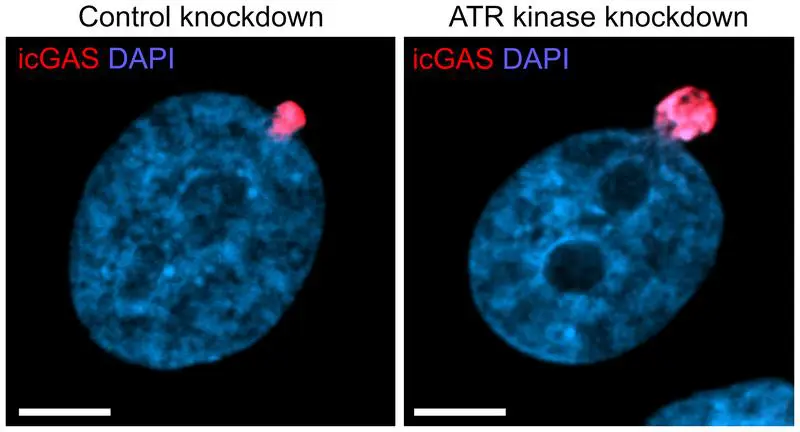
Für die Untersuchung nutzten die Wissenschaftler eine hochinvasive Krebszelllinie (Fibrosarkomzellen HT1080) und führten diese durch spezielle Mikrokanäle mit Durchmessern von drei oder acht Mikrometern. Besonders in den engen Kanälen kam es zu Rupturen der Kernhülle. Etwa 80 Sekunden nach einem solchen Bruch bildeten sich Aktinfilamente, die den Kern stabilisierten. Mithilfe der Atomic Force Microscopy wurde die mechanische Stabilität der Zellkerne untersucht. In Zusammenarbeit mit einem Kollegen aus dem Exzellenzcluster CIBSS gelang es, die Signalweiterleitung des DNA-Schadenssensors ATR an die Proteine DIAPH1 und DIAPH3 zu entschlüsseln, die die Bildung der Aktinfilamente anregen.

Schlüsselproteine für die Stabilität des Zellkerns
Die Studie zeigt, dass die Proteine DIAPH1, DIAPH3 und der DNA-Schadenssensor ATR eine zentrale Rolle im Schutzmechanismus spielen. Wurden diese Proteine blockiert, destabilisierte sich der Zellkern, und es kam vermehrt zu DNA-Austritt. Dieser Befund eröffnet neue Perspektiven für die Krebsforschung. Langfristig könnten gezielte Eingriffe in diesen Mechanismus entwickelt werden, um die Bildung von Metastasen zu verhindern oder Krankheiten zu behandeln, die mit instabilen Zellkernen einhergehen. Solche Ansätze könnten die Grundlage für neue therapeutische Strategien bilden.
Original Paper:
Redaktion: X-Press Journalistenbüro GbR
Gender-Hinweis. Die in diesem Text verwendeten Personenbezeichnungen beziehen sich immer gleichermaßen auf weibliche, männliche und diverse Personen. Auf eine Doppel/Dreifachnennung und gegenderte Bezeichnungen wird zugunsten einer besseren Lesbarkeit verzichtet.




