Neue Biomarker könnten frühere Diagnose der Osteoarthritis ermöglichen
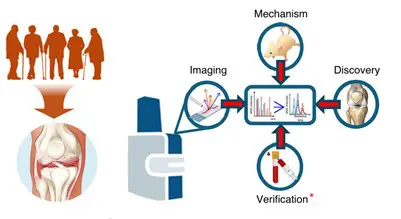
Forschende haben mit fortschrittlicher räumlicher Massenspektrometrie-Bildgebung (MALDI-MSI) und Proteomik der Synovialflüssigkeit frühe molekulare Umbauprozesse im subchondralen Knochen bei Knie-Osteoarthritis (OA) nachgewiesen. Diese Veränderungen treten bereits unter intaktem Knorpel auf und könnten als Biomarker für eine frühere Diagnose und bessere Überwachung des Krankheitsverlaufs dienen.
Osteoarthritis betrifft weltweit über 500 Millionen Menschen und zählt zu den Hauptursachen für Schmerzen, Behinderung und eingeschränkte Lebensqualität. Die Erkrankung wird meist erst diagnostiziert, wenn Knorpelverlust radiologisch nachweisbar ist und Symptome vorliegen – dann ist die Krankheit bereits weit fortgeschritten. Knorpelschäden sind weitgehend irreversibel, was frühzeitige Interventionen erschwert.
Die Studie, veröffentlicht am 26. Januar 2026 in der Zeitschrift Bone Research (Band 14, Artikelnummer 14, DOI: 10.1038/s41413-025-00495-0), untersuchte menschliches Kniegelenkgewebe von Patienten mit endstadium-OA und Nicht-OA-Kontrollen. Durch enzymatisches Targeting extrazellulärer Matrixproteine und hochaufgelöste räumliche Kartierung konnten Knorpel und Knochen molekular unterschieden werden.

Unter beschädigtem Knorpel zeigten sich im subchondralen Knochen eine starke Hochregulation spezifischer Kollagenfragmente und posttranslationaler Modifikationen, die mit Gewebeversteifung und Umgestaltung einhergehen. Ähnliche Signaturen traten auch unter strukturell intaktem Knorpel auf – ein Hinweis darauf, dass knochenbedingte Veränderungen früher einsetzen als bisher angenommen.
Viele der identifizierten Proteinfragmente aus dem Knochen waren in der Synovialflüssigkeit nachweisbar. Im Gegensatz dazu waren traditionelle Knorpelmarker in der OA-Gelenkflüssigkeit reduziert. Dies macht knochenspezifische Signaturen zu einer vielversprechenden Quelle für minimalinvasive Biomarker.
Die Studie wurde vom Buck Institute for Research on Aging geleitet, unter Leitung von Prof. Birgit Schilling (Geschäftsführerin des Proteomics and Metabolomics Core) mit maßgeblichen Beiträgen von Dr. Charles A. Schurman (Postdoktorand) und Dr. Joanna Bons (wissenschaftliche Mitarbeiterin).
Die Ergebnisse verändern das Verständnis von OA als Erkrankung des gesamten Gelenks, nicht nur des Knorpels. Veränderungen in Osteoblasten, Osteoklasten und Osteozyten im subchondralen Knochen beeinflussen durch mechanische und biochemische Signale die Knorpelgesundheit. Zukünftige Studien sollen diese Prozesse in Tiermodellen weiter klären.
Die Erkenntnisse bieten Grundlage für flüssigkeitsbasierte Tests zur Früherkennung von Risikopatienten, Überwachung des Verlaufs und Entwicklung gezielter Therapien, die das Fortschreiten verlangsamen oder verhindern könnten, bevor irreversible Schäden entstehen.
Original Paper:
Redaktion: X-Press Journalistenbüro GbR
Gender-Hinweis. Die in diesem Text verwendeten Personenbezeichnungen beziehen sich immer gleichermaßen auf weibliche, männliche und diverse Personen. Auf eine Doppel/Dreifachnennung und gegenderte Bezeichnungen wird zugunsten einer besseren Lesbarkeit verzichtet.




