Heidelberger Forschende enthüllen Rolle von Cystin bei Gefäßwachstum
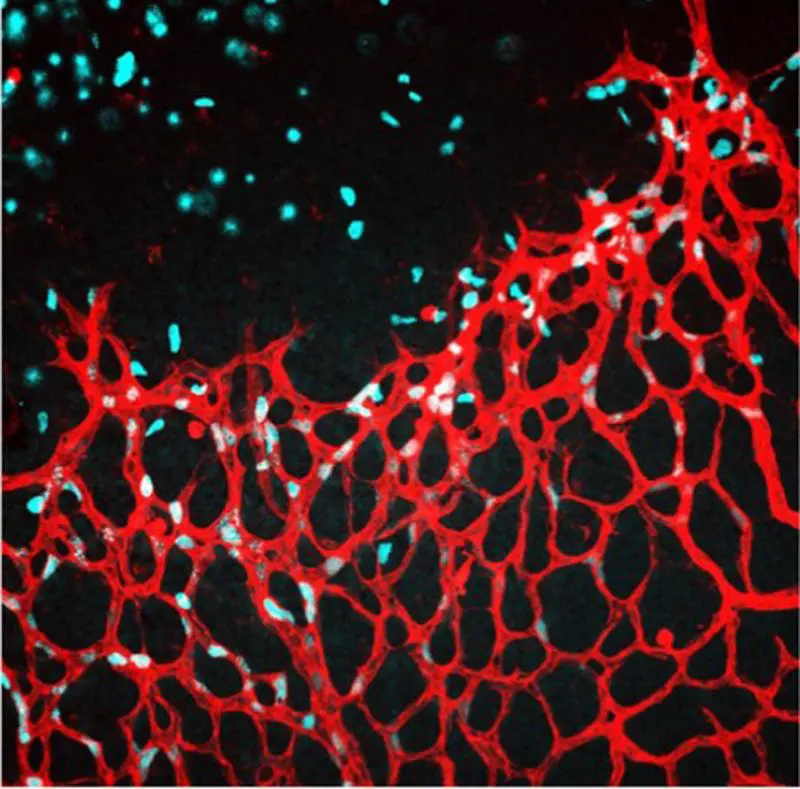
Forschende der Abteilung für Vaskuläre Dysfunktion an der Medizinischen Fakultät Mannheim der Universität Heidelberg haben einen unbekannten oxidativen Stoffwechselweg im Zellkern entdeckt, der das Wachstum und die Reparatur von Blutgefäßen steuert. Dieser Weg verbindet Cystin mit epigenetischer Genregulation und eröffnet neue Therapiemöglichkeiten für Gefäßschäden. Die Ergebnisse erschienen im Journal Cell Metabolism.
Herz-Kreislauf-Erkrankungen wie Herzinfarkt, Schlaganfall, Diabetes und Bluthochdruck zählen zu den häufigsten Todesursachen in Deutschland. Blutgefäße und ihre auskleidenden Endothelzellen spielen eine zentrale Rolle bei der Entstehung solcher Erkrankungen. Der Endothelstoffwechsel bildet die Basis für Geweberegeneration, Gesundheit und Langlebigkeit.
Cystin, bestehend aus zwei durch Disulfidbrücke verbundenen Cystein-Molekülen, kommt in proteinreichen Lebensmitteln wie Getreide, Nüssen, Fleisch, Fisch, Milchprodukten und Eiern vor. Obwohl Cystein nicht essenziell ist und der Körper es selbst herstellen kann, zeigen die Forscher, dass über Nahrung aufgenommenes Cystin im Zellkern oxidativ abgebaut wird und für Gefäßwachstum sowie Regeneration geschädigter Gefäße entscheidend ist.

Der nährstoffabhängige Mechanismus nimmt mit dem Alter ab, lässt sich jedoch durch ergänzende Cystin-Aufnahme reaktivieren. Dies fördert die Gefäßreparatur bei Retinopathie von Frühgeborenen, nach Myokardinfarkt und bei altersbedingten Verletzungen.
Endothelzellen, die sich auf Proliferation vorbereiten, importieren Cystin über einen Solute-Carrier-Transporter. Im Zellkern bildet Cystin einen Komplex mit Cystathionin-Gamma-Lyase (CSE) und Pyruvatdehydrogenase, wird oxidativ zu Pyruvat abgebaut und treibt die Produktion von Acetylgruppen an. Diese acetylieren spezifisch Histon H3, lockern die Chromatinstruktur und ermöglichen endotheliale Transkription, was zu Proliferation und Gefäßwachstum führt.
Die Studie umfasste eine klinische Kohorte, Mausmodelle in vivo, Zellkulturen mit Genmodulation sowie umfangreiche Gefäßanalysen.
Original Paper:
Redaktion: X-Press Journalistenbüro GbR
Gender-Hinweis. Die in diesem Text verwendeten Personenbezeichnungen beziehen sich immer gleichermaßen auf weibliche, männliche und diverse Personen. Auf eine Doppel/Dreifachnennung und gegenderte Bezeichnungen wird zugunsten einer besseren Lesbarkeit verzichtet.




