Elektrische Impedanztomographie (EIT) vereinfacht das Screening von Medikamenten
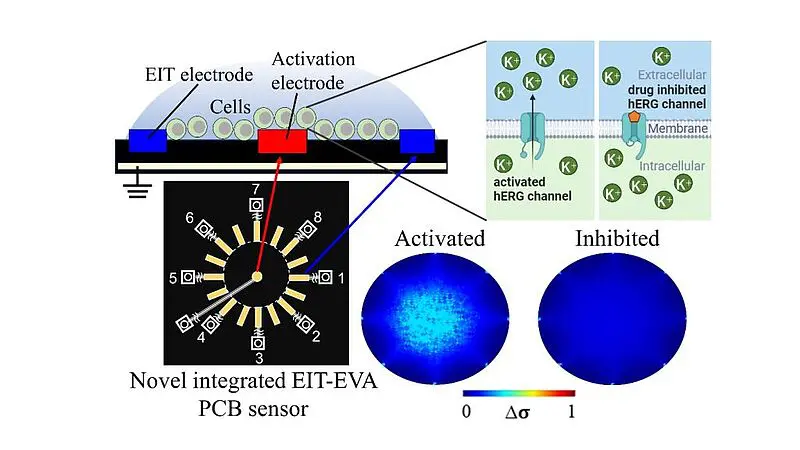
EIT misst die durch Ionenbewegungen verursachten Impedanzänderungen und liefert so räumliche Informationen über die extrazelluläre Ionenverteilung. Bei der EVA werden kontrollierte extrazelluläre Spannungen angelegt, um Änderungen der Ionenkanalaktivität zu bewirken. Dieser integrierte Ansatz ermöglichte es den Forschern, hERG-Kanäle nicht-invasiv zu aktivieren und die Veränderungen des Ionenflusses als Reaktion auf die Medikamentenexposition in Echtzeit zu überwachen.
Die Studie wurde bereits am 23. Mai 2024 in der Zeitschrift Lab on A Chip veröffentlicht.
Der EIT-EVA-Leiterplattensensor besteht aus nichtleitenden Epoxid-Glasfasern (FR-4 TG130) und misst 100 mm × 70 mm × 1,6 mm. Er hat 16 Elektroden für die EIT-Messung, die um eine zentrale Aktivierungselektrode für die EVA-Aktivierung angeordnet sind.
Das Prinzip: Die Zellen, die auf Wirkungen von Medikamenten auf Ionenkanäle untersucht werden sollen, werden auf den Sensor gelegt. An die Aktivierungselektrode wird eine Schrittspannung angelegt, die die Potenzialverteilung in dem die Zellen umgebenden extrazellulären Medium verändert. Diese Veränderung wirkt sich auf das Zellmembranpotenzial aus und aktiviert spannungsgesteuerte Ionenkanäle wie die hERG-Kanäle. Wenn sich diese Kanäle öffnen, wandern Kaliumionen aus den Zellen heraus und verändern den extrazellulären Widerstand, der mit dem EIT-System gemessen wird.
Die Wirkung des Medikaments auf den Ionenkanal wird dann durch die Überwachung der Veränderungen der extrazellulären Leitfähigkeit beobachtet. Wenn die hERG-Kanäle nicht durch das Medikament blockiert werden, steigt die Konzentration der Kaliumionen außerhalb der Zellen schnell an. Blockiert das Medikament jedoch die Kanäle, verlangsamt sich dieser Anstieg. Das System berechnet einen Index für das Hemmungsverhältnis (IR), indem es misst, wie schnell sich die extrazelluläre Ionenkonzentration im Laufe der Zeit ändert, was zeigt, wie stark das Medikament die hERG-Kanäle hemmt.
Um ihre Methode zu testen, setzten die Forscher Suspensionen von genetisch veränderten HEK 293-Zellen mit hERG-Kanälen dem Antiarrhythmikum E-4031 in verschiedenen Konzentrationen aus (0 nM, 1 nM, 3 nM, 10 nM, 30 nM und 100 nM). Nachdem sie das Medikament und die Zellsuspension mit einer Mikropipette in den Sensor gemischt hatten, führten sie 20 Sekunden lang EIT-Basismessungen durch, um eine Basislinie für die Ionenbewegung festzulegen. Anschließend wechselten sich 20-Sekunden-Zyklen von EVA-Aktivierung und EIT-Messungen ab.
Wenn die hERG-Kanäle durch EVA aktiviert wurden, verringerte sich der extrazelluläre Widerstand im Vergleich zur Grundlinie (aufgrund einer Zunahme der Kaliumionenkonzentration). Wenn jedoch die Konzentration von E-4031 anstieg und die hERG-Kanäle blockierte, wurden weniger Kaliumionen aus dem intrazellulären Bereich in den extrazellulären Bereich transportiert, was zu einer langsameren Abnahme des Widerstands führte.
Aus der IR-Antwortkurve ermittelten die Forscher, dass die halbmaximale Hemmkonzentration oder die Konzentration des Arzneimittels, die erforderlich ist, um die Funktion des hERG-Kanals um 50 % zu hemmen, 2,7 nM beträgt. Dieser Wert zeigt eine starke Korrelation (R2 = 0,85) mit den Ergebnissen der etablierten Patch-Clamp-Methode, was auf eine enge Übereinstimmung zwischen den beiden Techniken hinweist. Im Vergleich zu den herkömmlichen Methoden für das Screening von hERG-Kanälen ist die vorgeschlagene Methode nicht invasiv, hat eine schnelle Reaktionszeit und erfordert keine spezielle Ausbildung. „Dies kann zu effizienteren und kürzeren präklinischen Tests in der Arzneimittelforschung führen“, schreiben die Forscher.
Orginal Paper:
Non-invasive hERG channel screening based on electrical impedance tomography and extracellular voltage activation (EIT–EVA)
Authors: Muhammad Fathul Ihsan1, Daisuke Kawashima2,3, Songshi Li2, Satoshi Ogasawara4,5, Takeshi Murata4,5, and Masahiro Takei2
Affiliations: 1 Department of Mechanical Engineering, Graduate School of Science and
Engineering, Chiba University, Japan
2 Graduate School of Engineering, Chiba University, Japan
3 Institute for Advanced Academic Research, Chiba University, Japan
4 Department of Chemistry, Graduate School of Science, Chiba University, Japan
5 Molecular Chirality Research Center, Chiba University, Japan
Journal: Lab on a Chip
DOI: 10.1039/d4lc00230j
Lesen Sie auch:
- DGKL: „Wachsende Datenbank“: Wiley stellt aktualisierte AntiBase Library vor
- DGKL: Polypharmakologie: Open Source KI-Plattform entwirft Krebsmedikamente
- DGKL: Therapeutische Impfung gegen Hirntumore verlängert Leben der Erkrankten um bis zu sechs Jahren
Dazu passend:
Die Beiträge im News-Bereich werden erstellt vom
X-Press Journalistenbüro GbR
Schwimmbadstr. 29
37520 Osterode am Harz
Web: www.xpress-journalisten.com
E-Mail: redaktion(at)med-lab-portal.de
Gender-Hinweis. Die in diesem Text verwendeten Personenbezeichnungen beziehen sich immer gleichermaßen auf weibliche, männliche und diverse Personen. Auf eine Doppel/Dreifachnennung und gegenderte Bezeichnungen wird zugunsten einer besseren Lesbarkeit verzichtet.




