Bauchspeicheldrüsenkrebs und Immunsystem: Göttinger Wissenschaftler entdecken weitere Mechanismen
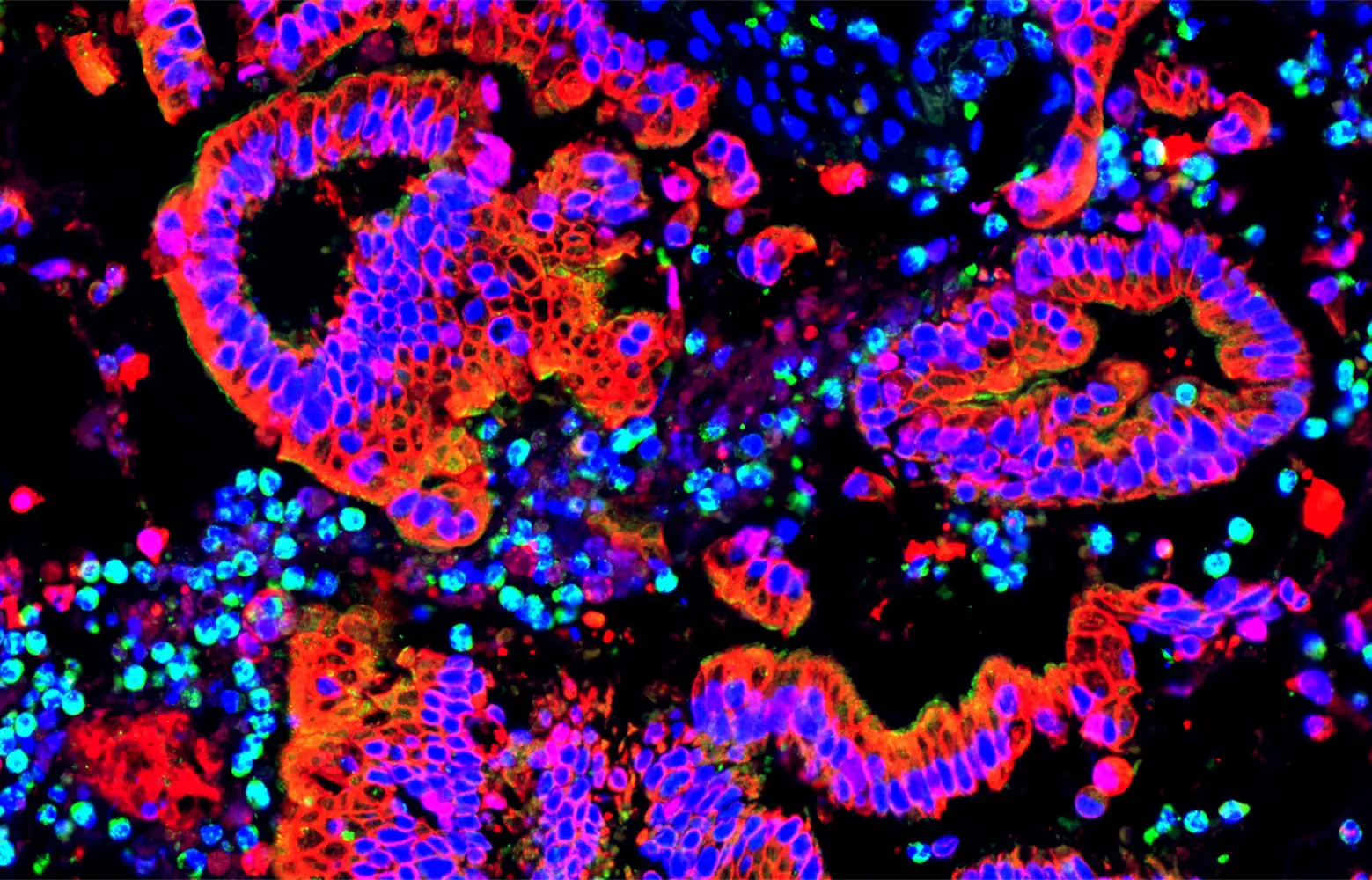
Forscher der Universitätsmedizin Göttingen (UMG) haben neue Wechselwirkungen zwischen Bauchspeicheldrüsenkrebszellen und dem Immunsystem aufgedeckt. Die Erkenntnisse der Forschungsgruppe liefern wichtige Ansätze für innovative Therapien.
Bauchspeicheldrüsenkrebs zählt bis heute zu den aggressivsten und tödlichsten Krebsarten. Er ist unter anderem schwer behandelbar, da die Tumoren oft große Unterschiede bei ein und demselben Patienten aufweisen. Diese Unterschiedlichkeit, auch Heterogenität genannt, erschwert die Wahl und das Ansprechen der Therapie. Besonders zwei Subtypen des Tumors – der klassische (CLA) und der basal-ähnliche (BL) Subtyp – sind entscheidend für den Krankheitsverlauf. Treten beide Subtypen in einem Tumor auf, verschlechtert dies das Überleben der Patienten und erschwert die Behandlung zusätzlich.
Forscher der Max-Eder-Nachwuchsgruppe unter Leitung von Dr. Shiv K. Singh in der Klinik für Gastroenterologie, gastrointestinale Onkologie und Endokrinologie der Universitätsmedizin Göttingen (UMG) haben jetzt in einer neuen Studie die Mechanismen untersucht, die diese Subtypen beeinflussen, und ihre Wechselwirkungen mit dem Immunsystem erforscht. Sie fanden heraus, dass Makrophagen hierbei eine zentrale Rolle spielen. Makrophagen sind Immunzellen, die durch Signalproteine des Tumors angelockt werden. Wirken Makrophagen und Tumorzellen zusammen, schaffen sie eine Umgebung, die die Aktivität sogenannter zytotoxischer T-Zellen, die „Killerzellen“ des Immunsystems, unterdrückt. Dadurch wird die Immunabwehr weiter geschwächt.
Die Forschenden konnten zeigen, dass Tumoren des Bauchspeicheldrüsenkrebses häufig aus einer Mischung von CLA- und BL-Subtypen bestehen, die unterschiedlich auf Behandlungen reagieren. Diese Heterogenität erschwert die Entwicklung zielgerichteter Therapieansätze. Die Studie hat gezeigt, dass einer der Subtypen gezielt Abwehrmechanismen des Immunsystems unterdrückt, um im Körper besser „überleben” zu können. Diese Manipulation geschieht über sogenannte epigenetische Programme, die beeinflussen, welche Gene aktiv sind. Diese Veränderung hemmt die Immunabwehr gegen den Tumor und schafft so ein günstiges Umfeld für das Tumorwachstum.
„Unsere Untersuchungen zeigen, dass das Zusammenspiel zwischen Tumor und Immunzellen eine zentrale Rolle spielt“, erklärt Dr. Shiv K. Singh, Leiter der Forschungsgruppe und Letztautor der Studie. „Eine wichtige Erkenntnis ist für uns, dass Immunzellen wie Makrophagen den Tumor beeinflussen und aggressiver machen können bei gleichzeitiger Schwächung der Immunabwehr.“ Die Studie identifizierte das von den Makrophagen ausgeschüttete entzündungsfördernde Signalprotein TNF-α als einen Schlüsselfaktor. Die Forschenden konnten zeigen, dass die Tumoren TNF-α nutzen, um Immunabwehr-Prozesse zu kontrollieren, die ihr Wachstum hemmen könnten. Das Versagen dieser Schutzmechanismen führt zu einem rascheren Fortschreiten der Krankheit und schlechteren Überlebenschancen für die Patient*innen.
Auf Basis dieser Erkenntnisse wollen die Forschenden eine neuartige Kombinationstherapie nutzen. Diese verbindet die Immuntherapie mit herkömmlicher Chemotherapie mit dem Ziel, die entzündungsfördernden Makrophagen gezielt zu hemmen und gleichzeitig die Funktion der zytotoxischen T-Zellen wiederherzustellen. Erste vorklinische Tests zeigen vielversprechende Ergebnisse: Die schädlichen Entzündungsreaktionen im Tumor konnten reduziert und die Überlebensraten verbessert werden.
„Unsere Ergebnisse bieten neue Einblicke in die Mechanismen, wie Tumoren die Immunabwehr umgehen“, sagt Dr. Singh. „Mit diesem Wissen wollen wir das Tumorumfeld gezielt so verändern, dass die Immunabwehr gestärkt wird.“ Besonders vielversprechend sei der Ansatz, TNF-α-produzierende Makrophagen zu hemmen, um die Aggressivität des Tumors zu reduzieren. Zukünftige klinische Studien müssen nun zeigen, ob und wie diese Erfolge im Labor in die medizinische Praxis auf Krebspatienten übertragen werden können. Ziel ist es, die Überlebenschancen und die Lebensqualität der Betroffenen nachhaltig zu verbessern.
Originalpublikation
Lukas Klein, Mengyu Tu, Niklas Krebs, Laura Urbach, Daniela Grimm, Muhammad Umair Latif, Frederike Penz, Anna Blandau, Xueyan Wu, Rebecca Diya Samuel, Stefan Küffer, Florian Wegwitz, Nathan Chan, Kazeera Aliar, Foram Vyas, Uday Kishore, Elisabeth Hessmann, Andreas Trumpp, Elisa Espinet, Argyris Papantonis , Rama Khokha, Volker Ellenrieder, Barbara Grünwald and Shiv K. Singh. Spatial tumor immune heterogeneity facilitates subtype co-existence and therapy response in pancreatic cancer. Nature Communications (2025). DOI: 10.1038/s41467-024-55330-70
Lesen Sie auch
Die Beiträge im News-Bereich werden erstellt vom X-Press Journalistenbüro
Gender-Hinweis. Die in diesem Text verwendeten Personenbezeichnungen beziehen sich immer gleichermaßen auf weibliche, männliche und diverse Personen. Auf eine Doppel/Dreifachnennung und gegenderte Bezeichnungen wird zugunsten einer besseren Lesbarkeit verzichtet.




