CRISPR-Nuklease Cas12a3 blockiert Proteinproduktion in infizierten Zellen
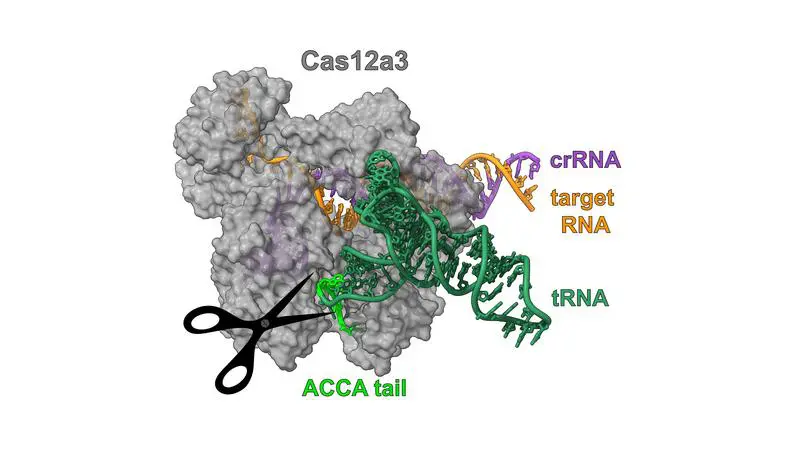
Ein internationales Forschungsteam aus Würzburg, Braunschweig und den USA hat eine bisher unbekannte CRISPR-Cas-Variante entdeckt. Die Nuklease Cas12a3 schneidet spezifisch den konservierten 3′-Schwanz von Transfer-RNAs (tRNAs) und legt damit die Proteinproduktion in infizierten Bakterienzellen lahm.
Bakterien wehren Virenangriffe durch verschiedene Mechanismen ab, darunter CRISPR-Cas-Systeme. Diese nutzen RNA-gesteuerte Cas-Nukleasen, um fremdes Erbgut zu erkennen und unschädlich zu machen. Bekannte Varianten schneiden meist DNA oder bauen RNA und DNA unspezifisch ab. Cas12a3 verfolgt einen anderen Ansatz: Nach Erkennung fremder RNA bindet es gezielt an den 3′-Schwanz von tRNAs und spaltet diesen. Der Schwanz trägt die aktivierte Aminosäure und ist für die Proteinbiosynthese essenziell. Seine Entfernung blockiert die Übersetzung von mRNA in Proteine, versetzt die Zelle in einen Ruhezustand und verhindert die Virusvermehrung.

Die Entdeckung ergab sich aus Untersuchungen zur Cas12a2-Familie, die sowohl DNA als auch RNA abbaut. Cas12a3 stellt das präzise Gegenstück dar. Mithilfe der Kryo-Elektronenmikroskopie wurde eine spezielle tRNA-Ladedomäne identifiziert, die den Schwanz exakt positioniert.
Das Team kombinierte Cas12a3 mit zwei weiteren zielgenauen Nukleasen und entwickelte einen Nachweis für RNAs von Influenzavirus, Respiratorischem Syncytial-Virus (RSV) und SARS-CoV-2. Dies erweitert die Möglichkeiten der CRISPR-basierten Diagnostik und könnte kostengünstige Point-of-Care-Tests ermöglichen.
Die Studie unterstreicht die funktionelle Vielfalt bakterieller Abwehrsysteme. Weitere Varianten sollen untersucht und Cas12a3 für diagnostische Anwendungen weiterentwickelt werden.
An der Arbeit waren das Helmholtz-Institut für RNA-basierte Infektionsforschung (HIRI) in Würzburg, das Helmholtz-Zentrum für Infektionsforschung (HZI) in Braunschweig, die Utah State University sowie Institutionen in Polen und Österreich beteiligt.
Original Paper:
RNA-triggered Cas12a3 cleaves tRNA tails to execute bacterial immunity | Nature
Redaktion: X-Press Journalistenbüro GbR
Gender-Hinweis. Die in diesem Text verwendeten Personenbezeichnungen beziehen sich immer gleichermaßen auf weibliche, männliche und diverse Personen. Auf eine Doppel/Dreifachnennung und gegenderte Bezeichnungen wird zugunsten einer besseren Lesbarkeit verzichtet.




