Calcium-sensitiver Schalter steigert die Wirksamkeit von Krebsmedikamenten
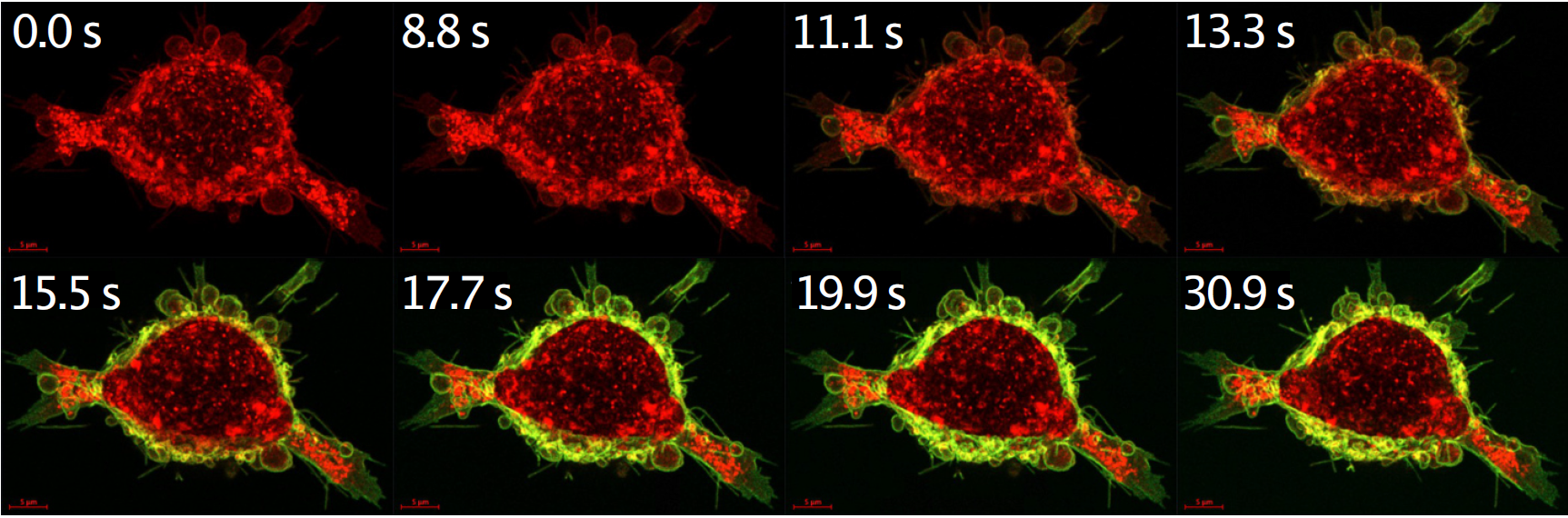
Antikörpermedikamente zur Krebsbekämpfung sollen in Tumorzellen eindringen und dort tief im Inneren eine tödliche Ladung freisetzen, doch allzu oft schaffen sie es nicht so weit. Eine neue Studie zeigt, wie diese Trojanische-Pferd-Strategie besser funktioniert, indem sie Kalziumunterschiede außerhalb und innerhalb der Zellen ausnutzt.
Ein Forschungsteam unter der Leitung von Sophia Hober, Professorin am KTH Royal Institute of Technology, berichtete über die Entwicklung eines kalziumaktivierten Verabreichungssystems, das ihrer Meinung nach eine präzisere Behandlung mit geringeren Dosen und weniger Kollateralschäden an gesundem Gewebe ermöglichen könnte. In Zusammenarbeit mit der Stanford University und der Umeå University veröffentlichten die Forscher ihre Ergebnisse in PNAS, der Zeitschrift der National Academy of Sciences.
Das Konzept zielt auf eine häufige Herausforderung bei zielgerichteten Medikamenten ab, die dazu neigen, sich zu stark an die von Tumoren exprimierten Rezeptoren zu binden. Positiv ist, dass diese starke Bindung die Tumorgewachssignale der Rezeptoren blockiert. Aber ADCs (Antikörper-Wirkstoff-Konjugate) sollen auch angreifen und abtöten, und allzu oft kann das Protein stecken bleiben, ohne jemals tiefer in das eigentliche Ziel der Zelle vorzudringen: ein saures Kompartiment namens Lysosom. Dort, in der Killzone, kann das Zielprotein abgebaut werden, wodurch ein Toxin freigesetzt wird, das den Zelltod verursacht.
Um dieses Problem zu vermeiden, entwickelten die Forscher einen kalziumempfindlichen Schalter, der sich fest an den Krebszellrezeptor an der Außenseite der Zelle bindet, wo relativ hohe Kalziumkonzentrationen im Blut und in der extrazellulären Flüssigkeit zu finden sind.
Sobald sie miteinander verbunden sind, werden das mit Medikamenten beladene Protein (oder die calciumregulierte Affinität, CaRA) und der epidermale Wachstumsfaktorrezeptor (EGFR) in die Zelle hineingezogen, in Kompartimente mit allmählich sinkendem Calciumspiegel. Und da ihre Verbindung calciumabhängig ist, gehen der Rezeptor und CaRA schließlich getrennte Wege: Der Rezeptor kann zur Membran zurückkehren, während CaRA seine Ladung weiter zum Lysosom transportiert.
„Der Kalziumschalter ist in das Medikamentendesign integriert“, sagt Hober. „Er misst den Kalziumspiegel und passt seine Bindungskraft automatisch an.“
Original Paper:
PNAS,
DOI: 10.1073/pnas.2509081122
Redaktion: X-Press Journalistenbüro GbR
Gender-Hinweis. Die in diesem Text verwendeten Personenbezeichnungen beziehen sich immer gleichermaßen auf weibliche, männliche und diverse Personen. Auf eine Doppel/Dreifachnennung und gegenderte Bezeichnungen wird zugunsten einer besseren Lesbarkeit verzichtet.




