Forschende klären Elektronenquelle für Peroxiredoxin-6-Enzyme
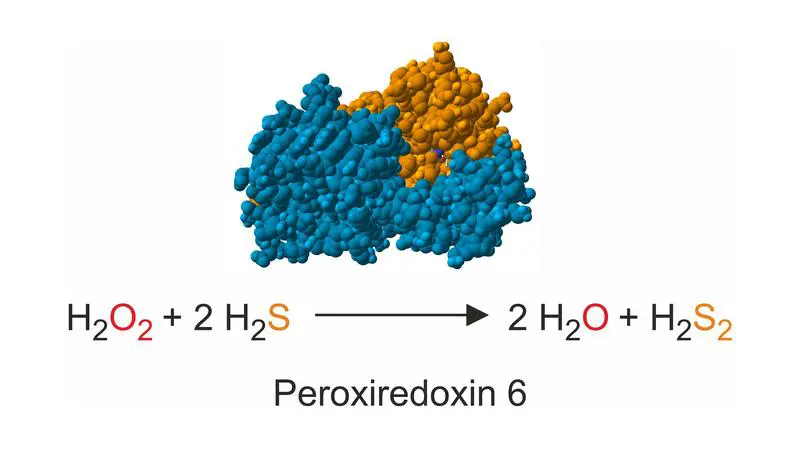
Eine Forschungsgruppe der Rheinland-Pfälzischen Technischen Universität (RPTU) hat ein seit mehr als 25 Jahren ungelöstes biochemisches Rätsel geklärt. Peroxidasen des sogenannten Peroxiredoxin-6-Typs, die Wasserstoffperoxid abbauen, beziehen ihre Elektronen aus Hydrogensulfid, dem Anion von Schwefelwasserstoff. Die Erkenntnisse verbinden erstmals den Peroxidstoffwechsel mit dem Sulfidstoffwechsel und sind im Fachmagazin „Advanced Science“ veröffentlicht. Gefördert wurde die Arbeit von der Deutschen Forschungsgemeinschaft.
Das Team um den Biochemiker Marcel Deponte untersuchte Enzyme aus Mensch und Malariaerreger Plasmodium falciparum. Beide Varianten reagierten sehr schnell mit Hydrogensulfid und reduzierten Wasserstoffperoxid zu Wasser. Dabei entstand Wasserstoffdisulfid, das als mögliche Quelle schützender Persulfide gilt. Die Ergebnisse zeigen, dass diese Reaktionsweise wahrscheinlich bei vielen Organismen mit Peroxiredoxin‑6‑Enzymen vorkommt.

Für die Experimente nutzten die Forschenden die Stopped-Flow-Methode, um die besonders schnellen Reaktionsabläufe im Bereich von Tausendstelsekunden zu erfassen. Die Enzyme wurden rekombinant in E.-coli‑Bakterien hergestellt und gereinigt. Die gut vergleichbaren Resultate aus den beiden Modellorganismen weisen auf eine universelle Bedeutung dieser Elektronentransfermechanismen hin.
Die Forschungsgruppe beschäftigt sich seit Jahren mit Redoxenzymen und deren Rolle bei der Entgiftung von Wasserstoffperoxid oder der Umsetzung in Signalprozesse. Die aktuellen Erkenntnisse leisten auch einen Beitrag zum Verständnis des Persulfidstoffwechsels und erweitern die wissenschaftliche Grundlage für künftige Arbeiten in der Molekularbiologie und Biochemie.
Original paper:
Redaktion: X-Press Journalistenbüro GbR
Gender-Hinweis. Die in diesem Text verwendeten Personenbezeichnungen beziehen sich immer gleichermaßen auf weibliche, männliche und diverse Personen. Auf eine Doppel/Dreifachnennung und gegenderte Bezeichnungen wird zugunsten einer besseren Lesbarkeit verzichtet.




