Durchbruch in der Alzheimer-Forschung: Struktur von Clusterin entschlüsselt
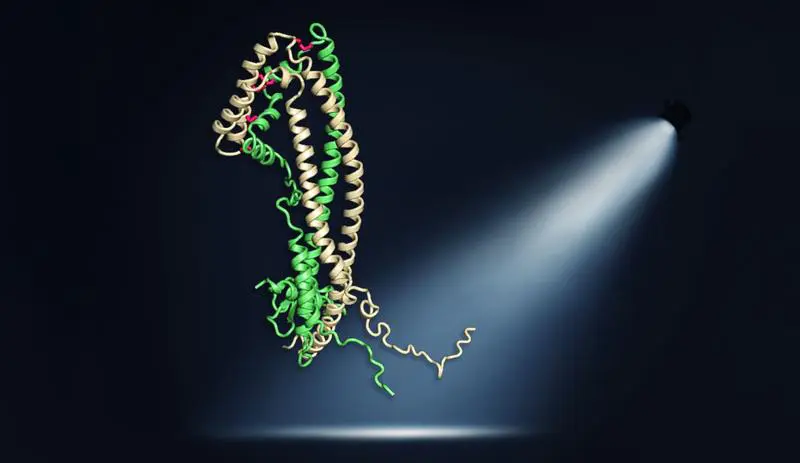
Ein Forschungsteam des Max-Planck-Instituts für Biochemie hat die dreidimensionale Kristallstruktur des menschlichen Proteins Clusterin erstmals durch Röntgenkristallographie aufgeklärt. Die Studie zeigt, dass Clusterin aus drei Domänen besteht, wobei zwei ungeordnete, hydrophobe Peptidfortsätze für seine vielfältigen Schutzfunktionen entscheidend sind. Diese Fortsätze ermöglichen es Clusterin, fehlgefaltete Proteine wie Amyloid-beta, Tau und α-Synuclein, die mit neurodegenerativen Erkrankungen wie Alzheimer und Parkinson in Verbindung stehen, zu binden und deren schädliche Aggregation im extrazellulären Raum zu verhindern.

Die Untersuchung belegt, dass die Chaperonfunktion von Clusterin, die Proteinverklumpung hemmt, auf diesen hydrophoben Peptidfortsätzen basiert. Durch biotechnologische Modifikation oder Entfernung der hydrophoben Aminosäuren in diesen Fortsätzen wurde die Schutzfunktion gegen Amyloid-beta-Aggregation aufgehoben. Die Peptidfortsätze sind zudem für die Bindung an Zelloberflächenrezeptoren und die Bildung von Lipoproteinkomplexen verantwortlich.
Die Ergebnisse sind von hoher medizinischer Relevanz. Clusterin, auch als Apolipoprotein-J bekannt, zeigt erhöhte Werte im Liquor von Alzheimer-Patienten und bindet extrazelluläre Amyloid-beta-Plaques. Die neuen Erkenntnisse zur Struktur und Funktion des Proteins liefern wichtige Ansätze für die Erforschung und Entwicklung neuer Therapien gegen neurodegenerative Erkrankungen.
Original Paper:
Lesen Sie auch:
Grünes Licht für neues Alzheimer-Medikament – MedLabPortal
Redaktion: X-Press Journalistenbüro GbR
Gender-Hinweis. Die in diesem Text verwendeten Personenbezeichnungen beziehen sich immer gleichermaßen auf weibliche, männliche und diverse Personen. Auf eine Doppel/Dreifachnennung und gegenderte Bezeichnungen wird zugunsten einer besseren Lesbarkeit verzichtet.




